RESUMEN:
El objetivo de este trabajo fue estudiar la influencia de la divisibilidad en comprimidos de prednisona 30 mg. La división de comprimidos se utiliza a menudo en la práctica farmacéutica para ajustar las dosis administradas. La prednisona es un corticoesteroide (glucocorticoide) utilizado en el tratamiento de sustitución en la insuficiencia adrenal incluyendo entre otras la enfermedad de Addison. Como medicamento de referencia se utilizó Dacortin 30 mg, el cual se comparó con dos medicamentos genéricos. Se estudiaron diferentes características farmacotécnicas para evaluar la calidad de los comprimidos estudiados, tales como la disgregación y la resistencia a la rotura. Atendiendo al estudio de fraccionamiento de comprimidos, se determinó la diferencia sobre el peso teórico esperado (pérdida de masa media tras el fraccionamiento de cada marca comercial). La liberación del principio activo se estudió mediante el ensayo de velocidad de disolución en fracciones de comprimidos. Los resultados de las tres presentaciones comerciales fueron estudiados y analizados estadísticamente con un nivel de confianza de un 95 %.
ABSTRACT:
The objective of this work was to study the influence of the division in prednisone tablets 30 mg. The division of tablets is often used in pharmaceutical practice to adjust the administered doses. Prednisone is a corticosteroid (glucocorticoid) used in the substitution treatment in adrenal insufficiency including, among others, Addison’s disease. As a reference drug, Dacortin 30 mg was used, and compared with two generic drugs. Different pharmacotechnic characteristics were studied to evaluate the quality of the tablets studied, such as disintegration, and the resistance to crushing. Based on the study of tablet fractionation, the difference over the expected theoretical weight was determined (loss of average mass after the fractionation of each trademark). The release of the active substance was carried out with dissolution rate study in fractions of tablets. The results of the three commercial formulations were studied and statistically analyzed with a confidence level of 95 %.
Palabras clave:
CLX; solubilidad; mezcla disolvente; parámetros termodinámicos; caracterización
1. INTRODUCCIÓN
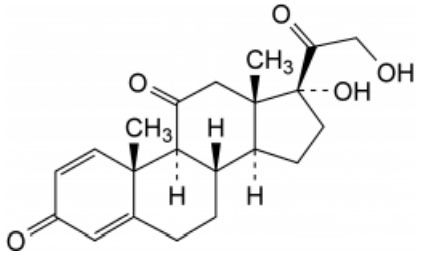
La prednisona (17,21-Dihidroxipregna-1,4-dieno-3,11,20-triona) fue el principio activo seleccionado para la realización del presente estudio debido a que es un fármaco de alta potencia administrado por vía oral en comprimidos en dosis bajas. Las presentaciones orales actualmente comercializadas son de 2,5, 5, 10 y 30 mg, careciéndose de la comercialización de dosis de 15 mg. Los glucocorticoides han sido utilizados clínicamente durante décadas como potentes antiinflamatorios e inmunosupresores (1). La prednisona es un glucocorticoide sintético no fluorado de absorción rápida, acción intermedia, con marcado efecto antiinflamatorio y escaso efecto mineral corticoide (Figura 1).
Su dosis diaria depende del tipo y severidad de la enfermedad, y respuesta del paciente. Esto hace que las dosis sean más variables que en otros principios activos.
La concentración plasmática máxima se alcanza entre 1 y 3 horas tras su administración. Se utiliza en tratamientos sistémicos exclusivamente por vía oral y afecta, dependiendo de la dosis, al metabolismo de casi todos los tejidos. Como glucocorticoide se puede aplicar para tratar multitud de patologías, tales como el tratamiento sustitutivo en la insuficiencia adrenal (enfermedad de Addison, síndrome adrenogenital, etc.), enfermedades reumáticas, autoinmunes, respiratorias, dermatológicas, hematológicas, malignas, renales e inflamatorias oculares (2). Entre las reacciones adversas de los glucocorticoides se destaca la supresión de la secreción endógena de corticoides, esta reacción es debida a la capacidad de los esteroides naturales y sintéticos de inhibir la secreción hipotalámica de corticotropina (CRH) y la secreción hipofisaria de adrenocorticotropa (ACTH), ya que producen modificaciones estables en la hipófisis y en las glándulas suprarrenales en proporción a las dosis administradas y a la duración de la administración. Por eso, el ajuste de dosis es tan importante. En el caso de administración de dosis suprafisiológicas con tratamientos superiores a dos semanas, los cambios atróficos se establecen de manera que, al suspender bruscamente la medicación corticotropa, sobreviene una insuficiencia suprarrenal aguda. Para evitar esta acción supresora de secreción endógena corticosteroide a tras tratamientos superiores a dos semanas, se pueden adoptar varias medidas, pero entre ellas destaca la reducción progresiva de la medicación con el fin de evitar el síndrome de deprivación glucocorticoidea (3). En ocasiones, no todas las dosis están disponibles comercialmente, lo que obliga al paciente a tener que dividir los comprimidos comerciales para adherirse adecuadamente a la pauta de retirada establecida por el facultativo.
En cuanto a las características fisicoquímicas, la prednisona es un polvo cristalino blanco o casi blanco prácticamente insoluble en agua, poco soluble en etanol 96 % y cloruro de metileno. Presenta la fórmula molecular C21H25O5, una masa molar de 358,43 g/mol y un punto de fusión a 233-235°C. Exhibe polimorfismo (4).
El fraccionamiento de comprimidos es una práctica muy común en la que se esperan desviaciones o pérdidas de las dosis obtenidas (5). Las fluctuaciones de las particiones irregulares a menudo resultan significativas en algunos casos, especialmente en fármacos con estrecho margen terapéutico. Sin embargo, para fármacos de larga semivida plasmática o amplio margen terapéutico, estas diferencias son clínicamente menos relevantes (6). La división puede realizarse a mano, con la ayuda de un cuchillo o con un dispositivo apropiado. Un comprimido es divisible solo si se cumplen los requisitos establecidos en la Farmacopea Europea (Ph. Eur.) (7), donde se explica que la efectividad de la ranura de fraccionamiento debe evaluarse a través de la uniformidad de cada fracción. Generalmente se acepta que la división proporciona dos partes iguales, aunque esto no siempre se cumple por diferentes razones, como en personas de edad avanzada, tipo de formulación, resistencia a la rotura, forma, dimensiones, geometría de la ranura del comprimido…, o bien, la utilización de distintos excipientes y procesos tecnológicos dan lugar a formas farmacéuticas que pueden presentar desiguales propiedades farmacotécnicas (8). Dichos factores deben ser estudiados durante la fase de desarrollo de un comprimido divisible, con el fin de obtener el diseño adecuado para asegurar su óptima divisibilidad (7).
El medicamento de referencia elegido ha sido Dacortin 30 mg, que se presenta en forma de comprimidos oblongos de color blanco, en la cara superior se observa una ranura transversal con el número “15” grabado a cada lado, equivalente a dos fracciones de 15 mg tras su división. La cara inferior contiene dos ranuras que dividen el comprimido en tres partes, cada una de ellas lleva grabado el número “10”, por lo que el comprimido se puede dividir en dos o tres partes iguales (9). Por otro lado, se seleccionaron dos medicamentos de comparación elaborados por laboratorios Kern Pharma y Laboratorios Cinfa, se trata de laboratorios de referencia en el desarrollo, fabricación y comercialización de medicamentos genéricos en España. Los comprimidos de los medicamentos genéricos se presentan como comprimidos redondos, blancos y ranurados por una cara, y como comprimidos blancos, oblongos biconvexos, ranurados en una cara y con la inscripción 15/15, y con dos ranuras y con la inscripción 10/10/10 en la otra, en cada formulación, Kern Pharma y Laboratorios Cinfa, respectivamente. En ambos casos, los comprimidos pueden dividirse en partes iguales de acuerdo con sus respectivas fichas técnicas (10, 11).
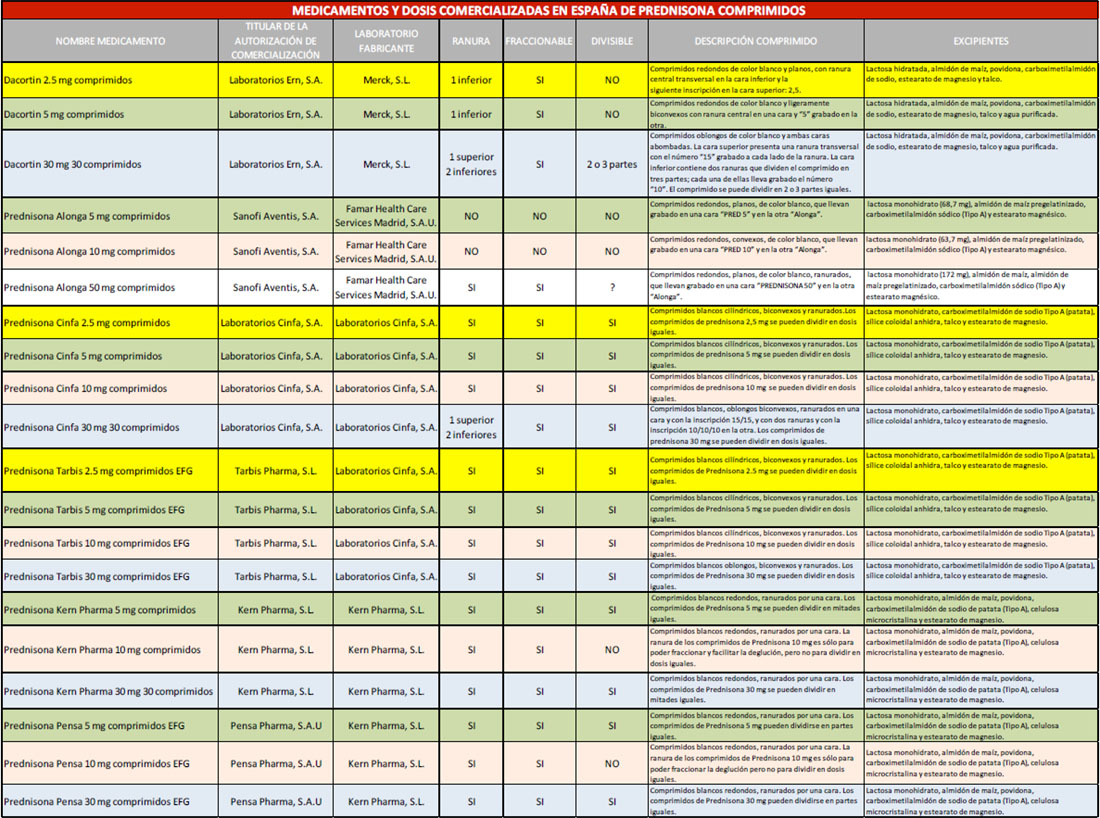
Son muchos los trabajos previos que han estudiado la influencia de la división de comprimidos y la uniformidad de peso en diferentes medicamentos en la práctica farmacéutica, como warfarina, digoxina, fenobarbital y prednisolona (12), aspirina (13), simvastatina, metoprolol, citalopram y lisinopril (14). En la Tabla 1 se indica el nombre del medicamento y las dosis comercializadas en España de prednisona comprimidos, así como el titular de la autorización de comercialización, los laboratorios fabricantes, si poseen ranura fraccionable, una breve descripción de cada comprimido y su composición cualitativa.
2. MATERIALES Y MÉTODOS
Para realizar el estudio se han adquirido a través de oficina de farmacia el principio activo prednisona polvo original (Prednisona, Fagron Ibérica S.A.U., lote: 18H07-BOS, caducidad: 04/20) y los medicamentos comercializados con prednisona en el mercado español (Dacortin 30 mg comprimidos, lote: E20222, caducidad: 07/2023 de los Laboratorios ERN S.A, comercializado desde 1989; Prednisona Cinfa 30 mg comprimidos, lote: 185285, caducidad: 05/2021 de Laboratorios Cinfa S.A. y Prednisona Kern 30 mg comprimidos, lote: N061, caducidad: 09-2023 de laboratorios Kern Pharma S.L.).
Se llevó a cabo un estudio preliminar de apariencia, peso medio y dimensiones. Se realizaron ensayos de disgregación y resistencia a la rotura descritos en la RFE (4). Los comprimidos estudiados fueron fraccionados a mano interviniendo en este proceso un sólo operador. Se dividieron treinta comprimidos de cada medicamento seleccionados al azar. Tanto los porcentajes de contenido como la diferencia de peso de los valores medios de cada muestra se compararon con los rangos de especificación recogidos en la Farmacopea de Estados Unidos (USP) (15).
El coeficiente de variación se calculó mediante la expresión: CV=(SdCm/Cm) *100. La preparación de datos se llevó a cabo en Excel® y el análisis estadístico con el software Statgraphics Centurion XVI. Para conseguir un criterio uniforme de comparación de los tres medicamentos de estudio, se han relativizado los valores de pesos de las divisiones y las pérdidas de dosis respecto al peso individual de cada comprimido. Las fracciones de cada medicamento se expresan en % respecto al peso del comprimido entero para poderlas comparar.
% Peso relativo = Peso fracción (mg) / Peso comprimido entero (mg) * 100
Para realizar los ensayos de disolución de los comprimidos se siguió la normativa de la Real Farmacopea Española (RFE) (4). Se utilizó un equipo de disolución de palas, Hanson Research SR8 Dissolution Test Station, de ocho vasos con fondo semiesférico, a una temperatura de 37 ± 0,5 ºC. Para la determinación de la concentración disuelta de cada fracción se recurrió a la espectrofotometría UV-VIS, disponiendo del equipo Spectronic Helios Gamma UV-Vis Spectrophotometer de Thermo Fisher Scientific, a la longitud de onda de máxima absorción previamente determinada, 242 nm, según la monografía de la USP (15).
Finalmente, se empleó el microscopio electrónico de barrido (SEM) (Electrón Zeiss Dsm 950) para obtener información sobre morfología, tamaño, forma, composición química y cristalográfica de las partículas que constituyen cada comprimido y evaluar su superficie. Un microscopio electrónico de barrido está basado en una fuente de emisión de electrones y un sistema de lentes magnéticas capaz de enfocar el haz electrónico y generar un barrido sobre la muestra. La interacción entre electrones de la muestra y el haz genera un conjunto de señales a partir del cual es posible construir una imagen topográfica. El análisis se realizó empleando un soporte de aluminio y un recubrimiento de las partículas con una fina capa de oro-paladio, las micrografías se obtuvieron a diversos aumentos y un voltaje de 10 kV.
Inicialmente, los medicamentos bajo estudio fueron sometidos a ensayos farmacotécnicos (uniformidad de masa, disgregación y resistencia a la rotura) de acuerdo con Farmacopea (4) y microscopía electrónica de barrido para lograr una caracterización física de los mismos.
3.1. Ensayo de uniformidad de masa.
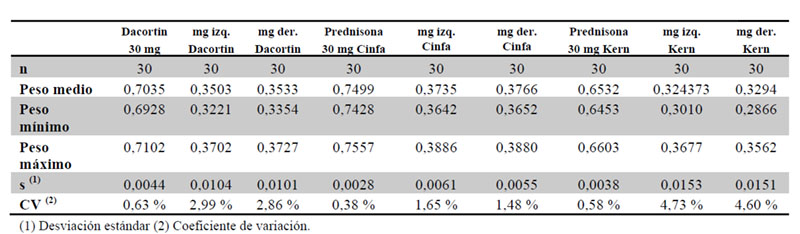
Se llevó a cabo para los tres medicamentos un ensayo de uniformidad de masa descrito en la RFE (2.9.5. Uniformidad de masa de las preparaciones unidosis) (4). Se pesaron 20 comprimidos tomados al azar y se determinó la masa promedio. La masa individual de como máximo 2 de las 20 unidades puede desviarse de la masa promedio en un porcentaje superior a 7,5 %, y la masa de ninguna unidad puede desviarse en más de un 15 %.
Los tres medicamentos en estudio cumplieron el ensayo de uniformidad de masa y como era de esperar se observó un incremento en la variación de peso medio para las fracciones (derecha e izquierda) respecto a los comprimidos enteros para los tres medicamentos, siendo Prednisona Cinfa 30 mg el medicamento con menor variabilidad tanto en comprimidos enteros como tras su fraccionamiento (Tabla 2).
3.2. Ensayo de disgregación.
Se llevó a cabo para los tres medicamentos el ensayo de disgregación descrito en la RFE (2.9.1. Disgregación de comprimidos y cápsulas) (4). El procedimiento indica que se añade un comprimido en cada uno de los 6 tubos utilizando como líquido de inmersión agua purificada a 37±2ºC. Se considera que el lote cumple el ensayo si las 6 unidades se disgregan en un tiempo inferior a 15 minutos. En la Tabla 3 se resumen los resultados obtenidos.

3.3. Resistencia a la rotura.
Se llevó a cabo para los tres medicamentos el ensayo de resistencia a la rotura descrito en la RFE (2.9.8. Resistencia de los comprimidos a la rotura) (4). Para ello, se tomó una muestra aleatoria de diez comprimidos, orientando el comprimido del mismo modo respecto a la dirección de la aplicación de la fuerza de rotura. Los resultados se expresan como valor medio, mínimo y máximo de las fuerzas medidas, expresadas en newtons (N). En la Tabla 3 se resumen los resultados obtenidos.
3.4. Microscopía electrónica de barrido (SEM).
La microscopía electrónica de barrido (SEM) es una técnica de obtención de imágenes ampliamente utilizada en investigación de materiales debido a su alta resolución para analizar características morfológicas, estructurales y químicas. El objetivo de este estudio fue caracterizar las partículas y superficies de los comprimidos fraccionados utilizando la SEM. Este método de microscopía puede proporcionar información útil sobre la rugosidad de la superficie ya que facilita una imagen precisa de la superficie. La rugosidad de la superficie es un factor importante, en aspectos como el recubrimiento de comprimidos, la absorción o en las interacciones partículapartícula.
En la Tabla 4 se muestran algunas de las microfotografías obtenidas para los tres medicamentos, se pueden observar que las mayores similitudes se presentaron entre Dacortin y Prednisona Kern. Dada la alta resolución que se puede lograr en SEM fue posible conocer las características más detalladas de cada fracción estudiada, se pudo reconocer estructuras cristalinas, porosidad y morfología superficial. A la vista de sus composiciones, en ambos casos aparecen almidón de maíz y povidona, por lo que se justificaría esas coincidencias en las imágenes microscópicas. El almidón se muestra como un polvo fino blanco de gránulos esféricos u ovoides muy pequeños y por otra parte, la povidona aparece como un fino polvo higroscópico, donde, si tiene valores de K iguales o inferiores a 30, se fabricaría mediante secado por pulverización, y se producen como esferas, mientras que la povidona K-90 o de mayor valor K, se fabricaría mediante secado en tambor, y se originan en placas. La Prednisona Cinfa 30 mg comprimidos tiene sílice coloidal al contrario que en el resto de las presentaciones. El dióxido de silicio coloidal es un polvo amorfo ligero, suelto, de color blanco azulado, inodoro, insípido y sin sabor, con un tamaño de partícula de aproximadamente 15 nm.

Los detalles de los excipientes, almidón de maíz, povidona y sílice coloidal, se describen en la Tabla 4 con diferentes aumentos. En las tres presentaciones intervienen, lactosa, carboximetil almidón sódico y estearato magnésico. A la vista de las imágenes microscópicas se puede concluir que Dacortin y Kern están fabricados probablemente por granulación húmeda, atendiendo a sus composiciones cualitativas y el tamaño de sus gránulos. Sin embargo, Prednisona Cinfa utiliza excipientes típicos de un proceso de compresión directa, formando una estructura más uniforme.
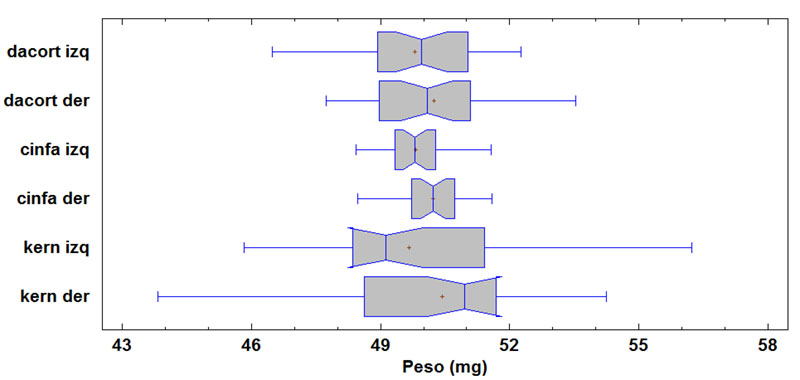
3.5. Estudio comparativo de divisibilidad de comprimidos
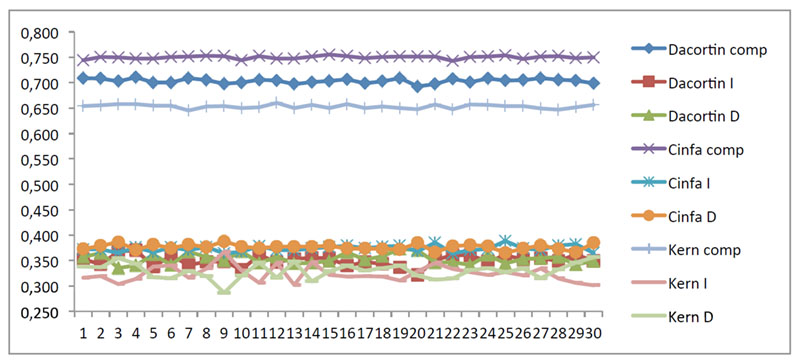
El procedimiento de división que requieren algunos comprimidos puede entrañar cierta dificultad para algunos pacientes como anteriormente se ha explicado, se deben destacar las características externas (forma, dureza, línea de puntuación, material de recubrimiento o tamaño del comprimido) como más relevantes (16-18). Se determinaron los pesos de los comprimidos y de las fracciones obtenidas tras fraccionamiento manual (Figura 2). En este trabajo se comparó, empleando un análisis estadístico comparativo de las fracciones administradas de cada medicamento frente a la dosis teórica, las fracciones administradas entre ellos, la pérdida de masa tras fraccionamiento, el % disuelto de cada medicamento frente al % disuelto mínimo a disolver y el % disuelto de cada uno de los medicamentos entre sí.
Se obtuvieron experimentalmente datos de concentración-absorbancia, mediante análisis estadístico de regresión simple, para la obtención de una recta de calibrado, que nos permitió cuantificar la concentración de fármaco disuelta en agua en el ensayo de disolución previsto en la USP (15). Para la calibración del modelo, se midió experimentalmente la absorbancia a once niveles de concentración (desde 0,004 a 0,015 mg/ml). Se determinó cada punto experimental por triplicado con el fin de reducir el error del modelo a la longitud de onda de máxima absorción ( λ = 242 nm), para un camino óptico de L=1 mm.
3.6. Comparación de fracción administrada vs dosis teórica (50 %)
Dado que los distintos medicamentos estudiados no tienen la misma masa, se relativizaron los pesos y pérdidas de éstos respecto al peso individual de cada comprimido.Mediante la realización de la prueba de hipótesis bilateral de fracción administrada 50 %, utilizando una prueba t de Student, prueba en la que el estadístico utilizado tiene una distribución tstudent, se estudia si el promedio de las fracciones difiere significativamente del teórico a administrar (50 %) (Tabla 5).
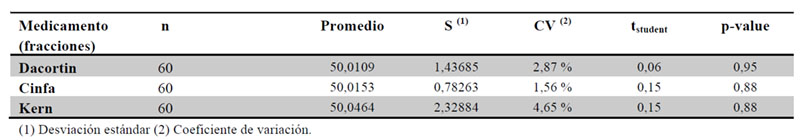
Podemos concluir que se acepta la hipótesis nula para cada medicamento (promedio peso fracción = 50,0 %) para los tres medicamentos, por tanto el método de corte manual realizado no impide que el paciente reciba la dosis correspondiente (50 %).
3.7. Comparación de las fracciones administradas entre los distintos medicamentos
En las Tablas 6 y 7 se resumen los resultados de la comparativa realizada con las fracciones obtenidas en peso relativo, tras el fraccionamiento en dos partes de los tres medicamentos en estudio.
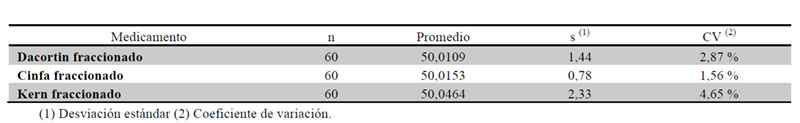
Se concluye que no existe una diferencia estadísticamente significativa entre los pesos medios de las 60 fracciones correspondientes a cada medicamento.
3.8. Comparación de los pesos relativos de las fracciones obtenidas
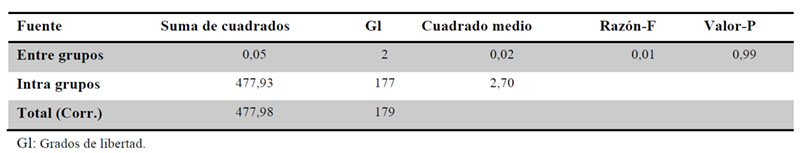
Se llevó a cabo test paramétrico ANOVA para la comparación de las medias de peso de las fracciones de los medicamentos estudiados, concluyéndose que no existen diferencias significativas entre las medias de las 6 fracciones. (Tablas 8, 9 y Figura 3).

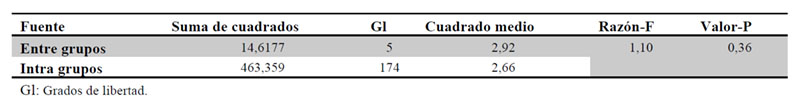
3.9. Comparación del % pérdida de masa tras fraccionamiento
Se realizó la comparativa del porcentaje de dosis perdida tras el fraccionamiento de cada medicamento. El medicamento que mayor fracción de masa perdió fue Prednisona Kern, pero a su vez es el que presenta menor variabilidad. Por el contrario, Dacortin y Cinfa presentaron pérdidas similares, considerándose grupos homogéneos entre sí y heterogéneos a Kern, de acuerdo a la prueba de rango múltiple utilizando la prueba de Bonferroni (Tablas 10 y 11).
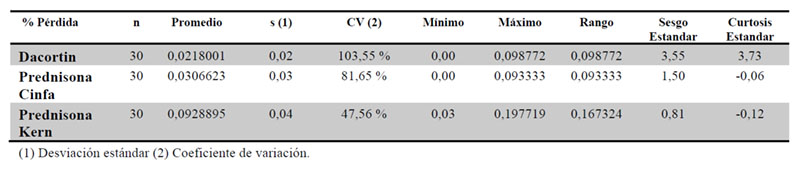

3.10. Determinación del porcentaje de fármaco disuelto de las fracciones
De acuerdo con la monografía USP 705 Quality attributes of tablets labeled as having a functional score (19), doce fracciones de cada medicamento que estén entre el 75-125 % del peso teórico deberán ser sometidas a un ensayo de disolución, cumpliéndose la especificación del estadio 2 de la monografía USP 711. En el caso de la monografía de USP comprimidos de prednisona, el medio de disolución son 900 ml agua, aparato 2 (palas), 50 rpm y longitud de onda 242 nm. El ensayo será conforme, si la media de la disolución de las 12 fracciones es ≥ 80 % y ningún valor individual ≤ 65 %), a los 30 minutos (Tabla 12).
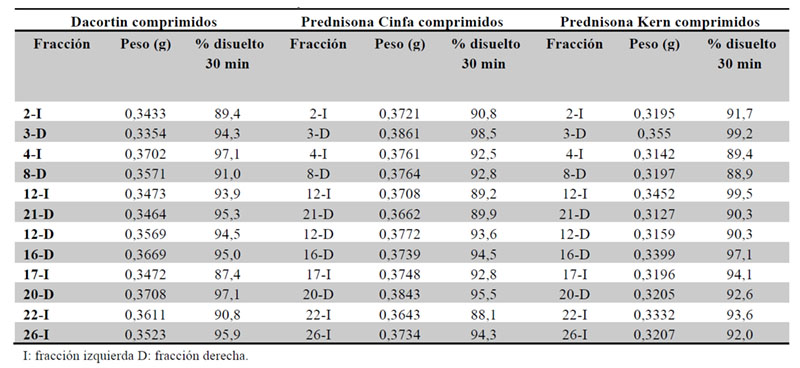
Los resultados obtenidos muestran que el % disuelto a 30 minutos de cada fracción individual es mayor o igual al 80 %, por lo que el ensayo se cumple de forma satisfactoria.
3.11. Comparación de % dosis disuelta vs % dosis mínima a disolver según USP monograph Prednisone tablets.
Mediante la realización de la prueba de hipótesis unilateral de media de dosis disuelta > 80 %, utilizando de nuevo el estadístico tstudent, se estudia si la media de las mitades difiere significativamente de la mínima dosis media teórica a disolver (80 %) (Tabla 13).
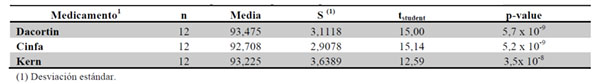
Podemos afirmar que la media del porcentaje de disolución de las mitades de los tres medicamentos, a los 30 minutos en estudio, es significativamente superior al 80 %.
3.12 Comparación de dosis media disuelta de los tres medicamentos en estudio.
Se realiza un estudio descriptivo del porcentaje disuelto de las fracciones de los medicamentos estudiados y se comparan entre sí mediante un análisis de varianza, estos cálculos se reflejan en las Tablas 14 y 15.

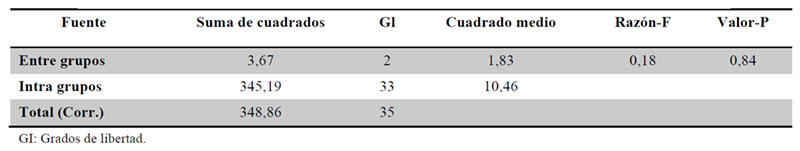
Podemos afirmar que no existe una diferencia estadísticamente significativa entre el promedio del porcentaje disuelto de las fracciones de los tres medicamentos estudiados.
4. CONCLUSIONES
En el año 2002, la Ph. Eur. introdujo un nuevo ensayo de fraccionamiento manual de comprimidos con ranura funcional, para la obtención de fracciones uniformes con la misma cantidad de principio activo. Para realizar este estudio se eligió la prednisona porque se trata de un fármaco potente y, porque los corticoesteroides se encuentran entre los medicamentos más utilizados en el campo de la Medicina.
Los tres medicamentos estudiados (Dacortin 30 mg, Prednisona Cinfa 30 mg y Prednisona Kern 30 mg) cumplieron el ensayo de uniformidad de masa descrito en la RFE.
Se observó un incremento en la variación de peso medio de las fracciones en comparación con el peso medio de los comprimidos enteros, siendo Prednisona Cinfa 30 mg el medicamento con menor variabilidad en ambos casos.
Los tres medicamentos en estudio satisfacen el ensayo de disgregación, siendo Prednisona 30 mg Kern (3´ 30´´) el que muestra el menor tiempo de disgregación, seguido de Dacortin 30 mg (4´ 10´´) y Prednisona Cinfa (12´ 05´´).
A la vista de las imágenes microscópicas se puede concluir que Dacortin y Kern están fabricados posiblemente por granulación húmeda, atendiendo a sus composiciones cualitativas y el tamaño de sus gránulos. Sin embargo, Prednisona Cinfa utiliza excipientes típicos de un proceso de compresión directa, integrando una estructura más uniforme.
Se compararon los pesos medios relativos de las fracciones administradas contra la dosis teórica (50 %), concluyéndose que el método de corte manual realizado no impide que el paciente reciba la dosis correspondiente. No se observan diferencias significativas entre los pesos relativos de diferentes fracciones administradas obtenidas al dividir los comprimidos correspondientes a cada uno de los tres medicamentos.
La comparación estadística de los pesos relativos de las fracciones obtenidas permite concluir que no existen diferencias significativas entre las medias de los seis grupos correspondientes a los tres medicamentos y sus fracciones izquierda y derecha.
El medicamento que mayor pérdida de masa mostró durante la división fue Prednisona Kern 30 mg, pero a su vez es el que presenta menor variabilidad. Las pérdidas de masa de Dacortin 30 mg y Prednisona Cinfa 30 mg no presentaron diferencias significativas.
El ensayo de disolución realizado sobre doce fracciones de los medicamentos en estudio demuestra el cumplimiento de las especificaciones normadas ( % disolución medio de las 12 fracciones ≥ 80 % y ningún valor individual ≤ 65 %, a los 30 minutos). Se demuestra estadísticamente que las medias obtenidas son significativamente superiores al 80 %.
Los porcentajes medios de disolución a los 30 minutos de los tres medicamentos en estudio no difieren significativamente entre sí.
El método de fraccionamiento manual garantiza la correcta división de los tres medicamentos estudiados, por tanto, se concluye que la división a mano en dos fracciones asegura la administración de 15 mg de prednisona al paciente y la intercambiabilidad entre los mismos.
5. REFERENCIAS
- JolienVandewalle, Astrid Luypaert, Karolien De Bosscher, Claude Libert, Therapeutic mechanisms of glucocorticoids, Trends End &Met. 2018; 29:42-54.
- Ficha técnica Farmacología Florez, J 3ª edición. Capítulo 52: Esteroides corticales y antiinflamatorios esteroideos.
- Chung S, Gi S, Kyungjin K. Circadian rhythm of adrenal glucocorticoid: its regulation and clinical implications. BBA-MBD. 2011; 2:581-91.
- Real Farmacopea Española (RFE) 5ª edición. 2015.
- Verrue, C., Mehuys, E., Boussery, K., Remon, J., Petrovic, M., Tablet-splitting: a common yet not so innocent practice. J Adv Nurs. 2011; 67:26–32.
- Walid A. Habib, Abdulaziz S. Alanizi, Magdi M. Abdelhamid, Fars K. Alanizi, Accuracy of tablet splitting: Comparison study between hand splitting and tablet cutter, Saudi Pharm J, 2014; 22:454-459.
- European Pharmacopoeia (Ph. Eur.) 9ª edición. 2016.
- Torrado G, Aberturas MR, Molpeceres J, Peña MA, Villarrubia A. Estudio comparativo de disgregación de diferentes formulaciones de olanzapina. An. R. Acad. Farm. 2011; 77(3):58-75.
- Ficha técnica Dacortin comprimidos (https://cima.aemps.es/cima/pdfs/ft/57819/FT_57819.pdf consultado el 12/03/2019).
- Ficha técnica Prednisona Kern https://cima.aemps.es/cima/pdfs/es/ft/70106/70106_ft.pdf, consultado el 12/03/2019
- Ficha técnica Prednisona Cinfa https://cima.aemps.es/cima/pdfs/es/ft/75676/FT_75676.html.pdf, consultado el 12/03/2019).
- Tahaineh, L. M., Gharaibeh, S. F. Tablet Splitting and Weight Uniformity of Half-Tablets of 4 Medications in Pharmacy Practice. J Pharm Practice. 2012; 25(4):471–476.
- Alexandra VR, Van Reuler BS., Jeske J K., Van Diemen BS. Subdivision of Aspirin Tablets? Use Your Hands: A Study on Aspirin Tablet Subdivision Using Four Different Methods. J Pharm Practice Research. 2018; 48:44-48.
- Hill SW, Varker AS, Karlage K, Myrdal PB. Analysis of drug content and weight uniformity for half-tablets of 6 commonly split medications. J Manag Care Pharm. 2009; 15(3):253-61.
- Prednisone tablets monograph. United States Pharmacopoeia USP-41-NF 36 2S, 2019.
- Somogyi, A. Meskó, L. Csorba, P. Szabó, R. Zelkó. Pharmaceutical counselling about different types of tablet-splitting methods based on the results of weighing tests and mechanical development of splitting devices. Eur J Pharm Sci. 2017; 106:262-273.
- Walid A. Habib, Abdulaziz S. Alanizi, Magdi M. Abdelhamid, Fars K. Alanizi, Accuracy of tablet splitting: Comparison study between hand splitting and tablet cutter. Saudi Pharm J. 2014; 22:454-459.
- Susan P. Identified safety risks with splitting and crushing oral medications. J Emergency Nursing. 2010; 36(2):156-158.
- USP 705 Quality attributes of tablets labeled as having a functional score.
